A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou a volta da obrigatoriedade do uso de máscaras dentro de aviões e em aeroportos do Brasil….
Tag: Anvisa

A Agência Nacional de Vigilância Sanitária (Anvisa) fará nova inspeção, entre os dias 13 e 15 de setembro…
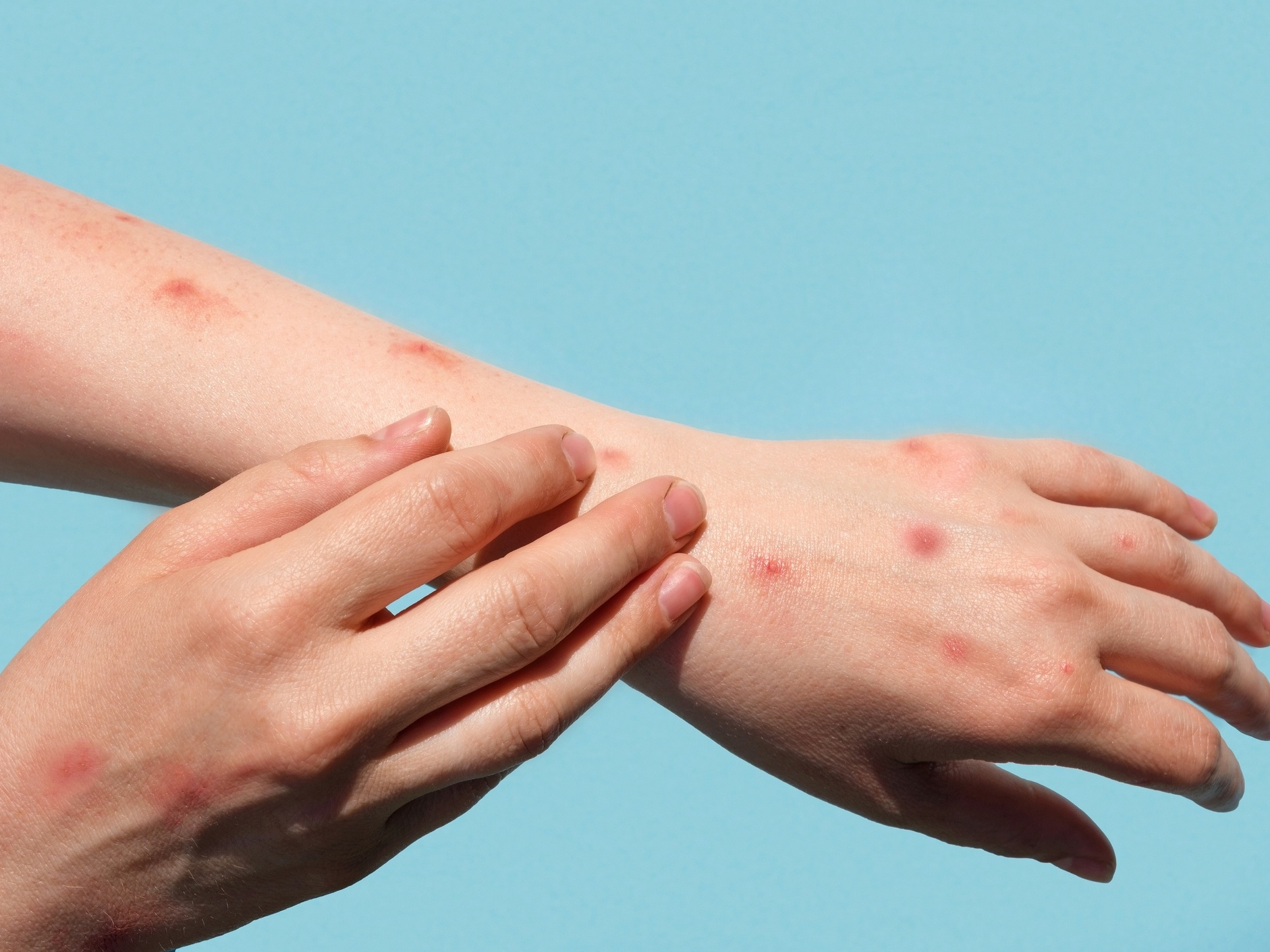
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, por unanimidade, nesta sexta-feira (19), a dispensa de registro para importação de medicamentos e vacinas destinados à prevenção ou ao tratamento da varíola dos macacos…
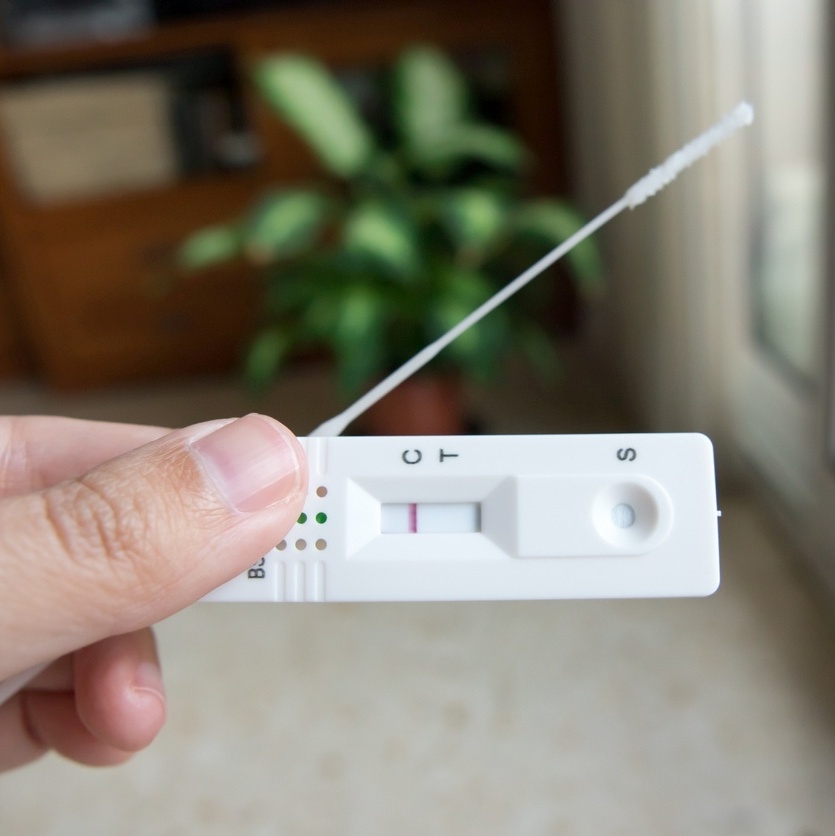
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, nesta sexta-feira (28), por unanimidade, o uso e a venda, no Brasil, de autotestes para detecção de Covid-19…
A Agência Nacional de Vigilância Sanitária (Anvisa) emitiu comunicado contraindicando o embarque de passageiros que possuem viagens programadas em navios de cruzeiro para os próximos dias após o aumento de casos de Covid-19. ..
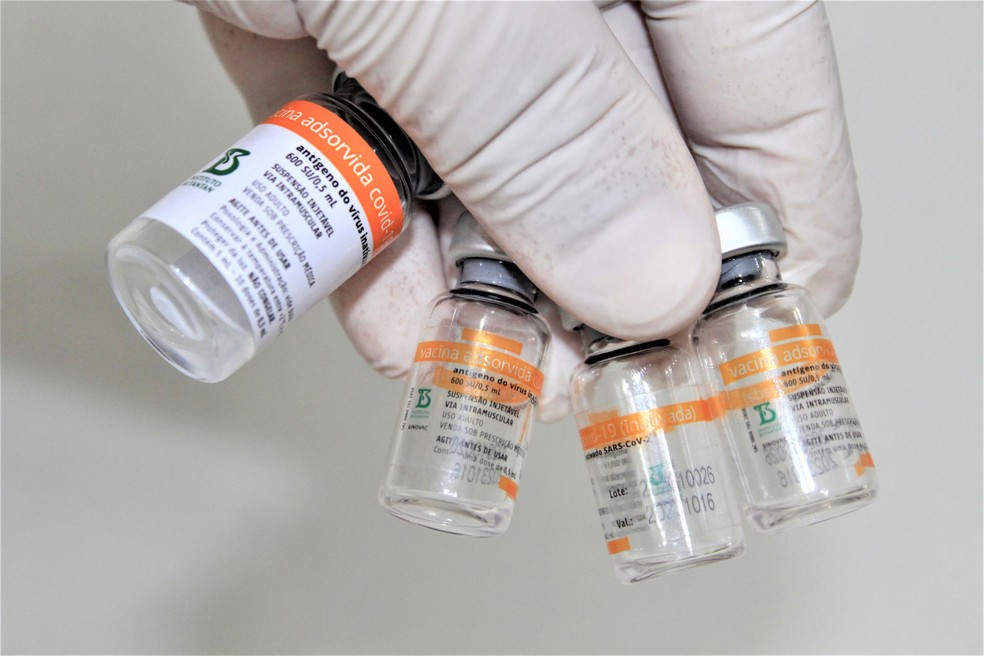
A aprovação da vacina Coronavac para crianças e adolescentes está emperrada na Agência Nacional de Vigilância Sanitária (Anvisa). O Butantan, responsável no Brasil pela produção,
O governador do Piauí e presidente do Consórcio Nordeste, Wellington Dias (PT), anunciou, nesta quinta-feira (5), a suspensão da importação da Sputnik-V. O comunicado aconteceu após a reunião entre o consórcio e o Fundo Soberano Russo…

A Agência Nacional de Vigilância Sanitária (Anvisa) informou que monitora a tripulação do navio ‘MV Pipit Arrow’ do Panamá, após um dos tripulantes testar positivo para a Covid-19. A embarcação está atracada em uma área de fundeio na Baía de São Marcos, em São Luís…

Assim como deve acontecer com a Covaxin, o Ministério da Saúde vai rescindir o contrato para a compra de 10 milhões de doses da vacina russa Sputnik V. O anúncio depende apenas da conclusão das análises jurídicas necessárias…
